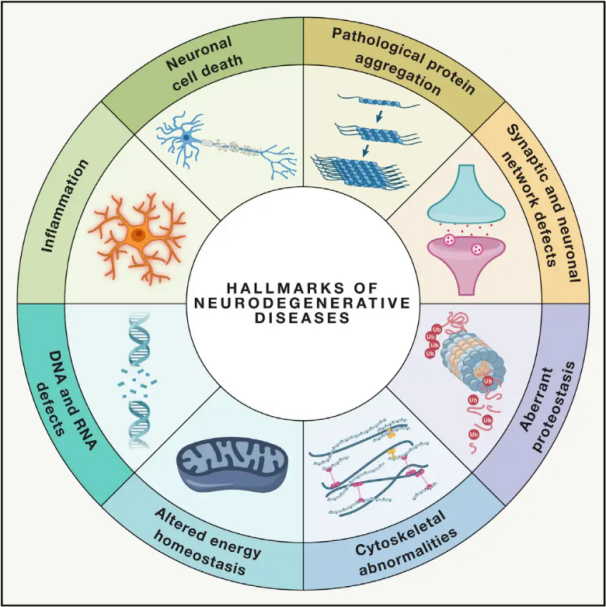
ნეიროდეგენერაციული დაავადებები(NDDs) ხასიათდება ტვინში ან ზურგის ტვინში სპეციფიკური დაუცველი ნეირონული პოპულაციების პროგრესული ან მუდმივი დაკარგვით. NDD-ების კლასიფიკაცია შეიძლება დაფუძნებული იყოს სხვადასხვა კრიტერიუმზე, მათ შორის ნეიროდეგენერაციის ანატომიურ განაწილებაზე (როგორიცაა ექსტრაპირამიდული დარღვევები, ფრონტოტემპორალური დეგენერაცია ან სპინოცერებრული ატაქსიები), პირველადი მოლეკულური ანომალიების (როგორიცაა ამილოიდი-β, პრიონები, ტაუ ან α-სინუკლეინი) ან ძირითადი კლინიკური მახასიათებლების (როგორიცაა პარკინსონის დაავადება, ამიოტროფიული ლატერალური სკლეროზი და დემენცია) ან ძირითადი კლინიკური მახასიათებლების (როგორიცაა პარკინსონის დაავადება, ამიოტროფიული ლატერალური სკლეროზი და დემენცია) მიუხედავად კლასიფიკაციისა და სიმპტომების გამოვლინების ამ განსხვავებებისა, ისეთ დარღვევებს, როგორიცაა პარკინსონის დაავადება (PD), ამიოტროფიული ლატერალური სკლეროზი (ALS) და ალცჰაიმერის დაავადება (AD), აქვთ საერთო ძირითადი პროცესები, რომლებიც იწვევს ნეირონულ დისფუნქციას და საბოლოოდ უჯრედების სიკვდილს.
მსოფლიო ჯანდაცვის ორგანიზაციის შეფასებით, 2040 წლისთვის ეს დაავადებები განვითარებულ ქვეყნებში სიკვდილიანობის მეორე წამყვან მიზეზად იქცევა, რადგანაც მსოფლიოში არადეგენერაციული დაავადებების (NDD) შემთხვევები მილიონობით ადამიანს აწუხებს. მიუხედავად იმისა, რომ კონკრეტულ დაავადებებთან დაკავშირებული სიმპტომების შესამსუბუქებლად და სამართავად სხვადასხვა მკურნალობა არსებობს, ამ დაავადებების პროგრესირების შენელების ან განკურნების ეფექტური მეთოდები ჯერ კიდევ მიუწვდომელია. ბოლოდროინდელი კვლევები მიუთითებს მკურნალობის პარადიგმების ცვლილებაზე სიმპტომური მართვიდან უჯრედების დამცავი მექანიზმების გამოყენებაზე შემდგომი გაუარესების თავიდან ასაცილებლად. ვრცელი მტკიცებულებები მიუთითებს, რომ ჟანგვითი სტრესი და ანთება მნიშვნელოვან როლს თამაშობენ ნეიროდეგენერაციაში, რაც ამ მექანიზმებს უჯრედების დაცვის კრიტიკულ სამიზნეებად ასახელებს. ბოლო წლებში ფუნდამენტურმა და კლინიკურმა კვლევებმა გამოავლინა ჰიპერბარული ჟანგბადის თერაპიის (HBOT) პოტენციალი ნეიროდეგენერაციული დაავადებების მკურნალობაში.
ჰიპერბარული ჟანგბადის თერაპიის (HBOT) გაგება
ჰიპერტენზიული თერაპია, როგორც წესი, გულისხმობს წნევის 1 აბსოლუტურ ატმოსფეროზე (ATA) - ზღვის დონეზე არსებულ წნევაზე - 90-120 წუთის განმავლობაში გაზრდას, რაც ხშირად მოითხოვს რამდენიმე სესიას, კონკრეტული სამკურნალო მდგომარეობიდან გამომდინარე. გაძლიერებული ჰაერის წნევა აუმჯობესებს უჯრედებისთვის ჟანგბადის მიწოდებას, რაც თავის მხრივ ასტიმულირებს ღეროვანი უჯრედების პროლიფერაციას და აძლიერებს გარკვეული ზრდის ფაქტორებით განპირობებულ შეხორცების პროცესებს.
თავდაპირველად, ჰიპერბარიული თერაპიის გამოყენება ბოილ-მარიოტის კანონს ეფუძნებოდა, რომელიც ქსოვილებში ჟანგბადის მაღალი დონის სარგებელთან ერთად გაზის ბუშტების წნევაზე დამოკიდებულ შემცირებას გულისხმობს. ცნობილია, რომ ჰიპერბარიული თერაპიის მიერ გამოწვეული ჰიპეროქსიური მდგომარეობით სარგებლობს პათოლოგიების მთელი რიგი, მათ შორის ნეკროზული ქსოვილები, რადიაციული დაზიანებები, ტრავმა, დამწვრობა, კომპარტმენტ სინდრომი და გაზის განგრენა, რომლებიც წყალქვეშა და ჰიპერბარიული სამედიცინო საზოგადოების მიერ არის ჩამოთვლილი. აღსანიშნავია, რომ ჰიპერბარიული თერაპიის გამოყენებამ ასევე აჩვენა ეფექტურობა, როგორც დამატებითი მკურნალობა სხვადასხვა ანთებითი ან ინფექციური დაავადების მოდელებში, როგორიცაა კოლიტი და სეფსისი. მისი ანთების საწინააღმდეგო და ჟანგვითი მექანიზმების გათვალისწინებით, ჰიპერბარიული თერაპიის გამოყენება მნიშვნელოვან პოტენციალს გვთავაზობს, როგორც ნეიროდეგენერაციული დაავადებების თერაპიული გზა.
ნეიროდეგენერაციული დაავადებების დროს ჰიპერბარული ჟანგბადის თერაპიის პრეკლინიკური კვლევები: 3×Tg თაგვის მოდელის მიმოხილვა
ერთ-ერთი აღსანიშნავი კვლევაფოკუსირებული იყო ალცჰაიმერის დაავადების (AD) 3×Tg თაგვის მოდელზე, რომელმაც წარმოაჩინა HBOT-ის თერაპიული პოტენციალი კოგნიტური დეფიციტის გაუმჯობესებაში. კვლევაში მონაწილეობდნენ 17 თვის მამრი 3×Tg თაგვები, რომლებიც შედარებული იყვნენ საკონტროლო ჯგუფად გამოყენებულ 14 თვის მამრ C57BL/6 თაგვებთან. კვლევამ აჩვენა, რომ HBOT არა მხოლოდ აუმჯობესებს კოგნიტურ ფუნქციას, არამედ მნიშვნელოვნად ამცირებს ანთებას, ფოლაქების დატვირთვას და Tau ფოსფორილირებას - AD პათოლოგიასთან დაკავშირებულ კრიტიკულ პროცესს.
ჰიპერბურთოზური თერაპიის (HBOT) დამცავი ეფექტები ნეიროანთების შემცირებას მიეწერებოდა. ეს დასტურდებოდა მიკროგლიური პროლიფერაციის, ასტროგლიოზის და პროანთებითი ციტოკინების სეკრეციის შემცირებით. ეს დასკვნები ხაზს უსვამს HBOT-ის ორმაგ როლს კოგნიტური შესაძლებლობების გაუმჯობესებაში და ამავდროულად ალცჰაიმერის დაავადებასთან დაკავშირებული ნეიროანთებითი პროცესების შემსუბუქებაში.
კიდევ ერთ პრეკლინიკურ მოდელში გამოყენებული იქნა 1-მეთილ-4-ფენილ-1,2,3,6-ტეტრაჰიდროპირიდინის (MPTP) თაგვები ნეირონულ ფუნქციასა და მოტორულ შესაძლებლობებზე ჰიპერბოთერმიის (HBOT) დამცავი მექანიზმების შესაფასებლად. შედეგებმა აჩვენა, რომ HBOT ხელს უწყობდა ამ თაგვებში მოტორული აქტივობისა და მოჭიდების ძალის გაძლიერებას, რაც კორელაციაში იყო მიტოქონდრიული ბიოგენეზის სიგნალიზაციის ზრდასთან, კერძოდ, SIRT-1, PGC-1α და TFAM-ის გააქტიურების გზით. ეს ხაზს უსვამს მიტოქონდრიული ფუნქციის მნიშვნელოვან როლს HBOT-ის ნეიროპროტექტორულ ეფექტებში.
ნეიროდეგენერაციული დაავადებების დროს ჰიპერბოროტიტის თერაპიის (HBOT) მექანიზმები
ჰიპოქსიით ინდუცირებადი ფაქტორი-1 (HIF-1) ნეიროდეგენერაციული დაავადებების დროს ჰიპერბოტანიკური თერაპიის (HBOT) გამოყენების ძირითადი პრინციპი მდგომარეობს ჟანგბადის მიწოდების შემცირებასა და ნეიროდეგენერაციული ცვლილებებისადმი მგრძნობელობას შორის კავშირში. ჰიპოქსიით ინდუცირებადი ფაქტორი-1 (HIF-1) ცენტრალურ როლს ასრულებს ტრანსკრიფციის ფაქტორად, რომელიც უზრუნველყოფს უჯრედულ ადაპტაციას ჟანგბადის დაბალ წნევასთან და მონაწილეობს სხვადასხვა ნეიროდეგენერაციულ დაავადებებში, მათ შორის ალცჰაიმერის, პერიფერიული დაავადების, ჰანტინგტონის დაავადების და ამიოტროფული გვერდითი სკლეროზის განვითარებაში, რაც მას წამლის მნიშვნელოვან სამიზნედ აქცევს.
ვინაიდან ასაკი მრავალი ნეიროდეგენერაციული დაავადების მნიშვნელოვანი რისკ-ფაქტორია, სასიცოცხლოდ მნიშვნელოვანია HBOT-ის ზემოქმედების შესწავლა დაბერების ნეირობიოლოგიაზე. კვლევებმა აჩვენა, რომ HBOT-ს შეუძლია გააუმჯობესოს ასაკთან დაკავშირებული კოგნიტური დეფიციტი ჯანმრთელ ხანდაზმულ პირებში.გარდა ამისა, ხანდაზმულ პაციენტებში, რომლებსაც მეხსიერების მნიშვნელოვანი დარღვევა ჰქონდათ, HBOT-ის ზემოქმედების შემდეგ აღინიშნა კოგნიტური გაუმჯობესება და ცერებრალური სისხლის მიმოქცევის მომატება.
1. ჰიპერმგრძნობელობის თერაპიის (HBOT) გავლენა ანთებასა და ოქსიდაციურ სტრესზე
ჰიპერბოლურმა თერაპიამ (HBOT) აჩვენა ნეიროანთების შემსუბუქების უნარი ტვინის მძიმე დისფუნქციის მქონე პაციენტებში. მას გააჩნია ანთების საწინააღმდეგო ციტოკინების (როგორიცაა IL-1β, IL-12, TNFα და IFNγ) დაქვეითების და ანთების საწინააღმდეგო ციტოკინების (როგორიცაა IL-10) გაზრდის უნარი. ზოგიერთი მკვლევარი ვარაუდობს, რომ HBOT-ის მიერ გენერირებული რეაქტიული ჟანგბადის სახეობები (ROS) თერაპიის რამდენიმე სასარგებლო ეფექტს განაპირობებს. შესაბამისად, მისი წნევაზე დამოკიდებული ბუშტუკების შემამცირებელი მოქმედებისა და ქსოვილებში ჟანგბადის მაღალი სატურაციის მიღწევის გარდა, HBOT-თან დაკავშირებული დადებითი შედეგები ნაწილობრივ დამოკიდებულია წარმოქმნილი ROS-ის ფიზიოლოგიურ როლზე.
2. HBOT-ის გავლენა აპოპტოზსა და ნეიროპროტექციაზე
კვლევებმა აჩვენა, რომ HBOT-ს შეუძლია შეამციროს p38 მიტოგენ-აქტივირებული ცილოვანი კინაზას (MAPK) ჰიპოკამპის ფოსფორილირება, რაც შემდგომში აუმჯობესებს შემეცნებით უნარს და ამცირებს ჰიპოკამპის დაზიანებას. როგორც დამოუკიდებლად, ასევე გინკგო ბილობას ექსტრაქტთან ერთად HBOT ამცირებს Bax-ის ექსპრესიას და კასპაზა-9/3-ის აქტივობას, რაც იწვევს aβ25-35-ით ინდუცირებული აპოპტოზის მაჩვენებლების შემცირებას მღრღნელების მოდელებში. გარდა ამისა, კიდევ ერთმა კვლევამ აჩვენა, რომ HBOT-ის წინაპირობა იწვევდა ცერებრალური იშემიის მიმართ ტოლერანტობას, მექანიზმებით, რომლებიც მოიცავდა SIRT1 ექსპრესიის ზრდას, B-უჯრედული ლიმფომა 2-ის (Bcl-2) დონის მომატებასთან და აქტიური კასპაზა-3-ის შემცირებასთან ერთად, რაც ხაზს უსვამს HBOT-ის ნეიროპროტექტორულ და ანტიაპოპტოზურ თვისებებს.
3. ჰიპერბოროტიდული თერაპიის (HBOT) გავლენა სისხლის მიმოქცევასა დანეიროგენეზი
სუბიექტების HBOT-ის ზემოქმედება დაკავშირებულია თავის ქალას სისხლძარღვთა სისტემაზე მრავალ ეფექტთან, მათ შორის ჰემატოენცეფალური ბარიერის გამტარიანობის გაძლიერებასთან, ანგიოგენეზის ხელშეწყობასთან და შეშუპების შემცირებასთან. ქსოვილებისთვის ჟანგბადის მიწოდების გაზრდის გარდა, HBOTხელს უწყობს სისხლძარღვთა ფორმირებასტრანსკრიფციული ფაქტორების, როგორიცაა სისხლძარღვთა ენდოთელური ზრდის ფაქტორი, გააქტიურებით და ნერვული ღეროვანი უჯრედების პროლიფერაციის სტიმულირებით.
4. ჰიპერბოროტიდური თერაპიის (HBOT) ეპიგენეტიკური ეფექტები
კვლევებმა აჩვენა, რომ ადამიანის მიკროვასკულური ენდოთელური უჯრედების (HMEC-1) ჰიპერბარული ჟანგბადის ზემოქმედება მნიშვნელოვნად არეგულირებს 8,101 გენს, მათ შორის როგორც მომატებულ, ასევე დაქვეითებულ ექსპრესიას, რაც ხაზს უსვამს ანტიოქსიდანტური პასუხის გზებთან დაკავშირებული გენების ექსპრესიის ზრდას.
დასკვნა
დროთა განმავლობაში ჰიპერბოროტის თერაპიის (HBOT) გამოყენებამ მნიშვნელოვანი წინსვლა განიცადა, რაც ადასტურებს მის ხელმისაწვდომობას, სანდოობასა და უსაფრთხოებას კლინიკურ პრაქტიკაში. მიუხედავად იმისა, რომ ჰიპერბოროტის თერაპია შესწავლილია, როგორც არალეგალური დაავადების სამკურნალო საშუალება და ჩატარდა გარკვეული კვლევები, კვლავ აუცილებელია ინტენსიური კვლევების ჩატარება ამ მდგომარეობების მკურნალობისას HBOT პრაქტიკის სტანდარტიზაციის მიზნით. აუცილებელია შემდგომი კვლევების ჩატარება ოპტიმალური მკურნალობის სიხშირის დასადგენად და პაციენტებისთვის სასარგებლო ეფექტების ხარისხის შესაფასებლად.
შეჯამებისთვის, ჰიპერბარული ჟანგბადისა და ნეიროდეგენერაციული დაავადებების გადაკვეთა თერაპიული შესაძლებლობების პერსპექტიულ საზღვარს აჩვენებს, რაც კლინიკურ გარემოში კვლევისა და დადასტურების გაგრძელებას მოითხოვს.
გამოქვეყნების დრო: 2025 წლის 16 მაისი

