თანამედროვე მედიცინის სფეროში ანტიბიოტიკები ერთ-ერთ უმნიშვნელოვანეს მიღწევად იქცა, რამაც მკვეთრად შეამცირა მიკრობული ინფექციებით გამოწვეული შემთხვევებისა და სიკვდილიანობის მაჩვენებლები. ბაქტერიული ინფექციების კლინიკური შედეგების შეცვლის მათმა უნარმა უამრავი პაციენტის სიცოცხლის ხანგრძლივობა გაზარდა. ანტიბიოტიკები კრიტიკულად მნიშვნელოვანია კომპლექსური სამედიცინო პროცედურების დროს, მათ შორის ოპერაციების, იმპლანტების ჩადგმის, ტრანსპლანტაციისა და ქიმიოთერაპიის დროს. თუმცა, ანტიბიოტიკების მიმართ რეზისტენტული პათოგენების გაჩენა სულ უფრო მეტ შეშფოთებას იწვევს, რაც დროთა განმავლობაში ამცირებს ამ პრეპარატების ეფექტურობას. ანტიბიოტიკების მიმართ რეზისტენტობის შემთხვევები დაფიქსირებულია ანტიბიოტიკების ყველა კატეგორიაში, მიკრობული მუტაციების განვითარებისას. ანტიმიკრობული პრეპარატების მიერ განხორციელებულმა სელექციურმა ზეწოლამ ხელი შეუწყო რეზისტენტული შტამების ზრდას, რაც მნიშვნელოვან გამოწვევას წარმოადგენს გლობალური ჯანმრთელობისთვის.
ანტიმიკრობული რეზისტენტობის აქტუალურ პრობლემასთან საბრძოლველად აუცილებელია ინფექციის კონტროლის ეფექტური პოლიტიკის გატარება, რომელიც შეამცირებს რეზისტენტული პათოგენების გავრცელებას ანტიბიოტიკების გამოყენების შემცირებასთან ერთად. გარდა ამისა, არსებობს ალტერნატიული მკურნალობის მეთოდების საჭიროება. ამ კონტექსტში პერსპექტიულ მეთოდად გამოჩნდა ჰიპერბარული ჟანგბადის თერაპია (HBOT), რომელიც გულისხმობს 100%-იანი ჟანგბადის ინჰალაციას გარკვეული წნევის დონეზე გარკვეული პერიოდის განმავლობაში. ინფექციების პირველადი ან დამატებითი მკურნალობის სახით პოზიციონირებული HBOT შესაძლოა ახალ იმედს იძლეოდეს ანტიბიოტიკების მიმართ რეზისტენტული პათოგენებით გამოწვეული მწვავე ინფექციების მკურნალობაში.
ეს თერაპია სულ უფრო ხშირად გამოიყენება, როგორც პირველადი ან ალტერნატიული მკურნალობა სხვადასხვა მდგომარეობისთვის, მათ შორის ანთების, ნახშირჟანგით მოწამვლის, ქრონიკული ჭრილობების, იშემიური დაავადებებისა და ინფექციების დროს. ჰიპერბალანსირებული თერაპიის კლინიკური გამოყენება ინფექციების მკურნალობაში ღრმაა, რაც პაციენტებს ფასდაუდებელ უპირატესობებს სთავაზობს.

ჰიპერბარული ჟანგბადის თერაპიის კლინიკური გამოყენება ინფექციის დროს
ამჟამინდელი მტკიცებულებები მტკიცედ უჭერს მხარს ჰიპერტენზიული თერაპიის (HBOT) გამოყენებას, როგორც დამოუკიდებელ, ასევე დამატებით მკურნალობად, რაც მნიშვნელოვან სარგებელს მოუტანს ინფიცირებულ პაციენტებს. ჰიპერტენზიული თერაპიის (HBOT) დროს არტერიული სისხლის ჟანგბადის წნევა შეიძლება გაიზარდოს 2000 მმ.ვწყ.სვ-მდე, ხოლო შედეგად მიღებული ჟანგბად-ქსოვილოვანი წნევის მაღალი გრადიენტი ქსოვილებში ჟანგბადის დონეს 500 მმ.ვწყ.სვ-მდე აწევს. ასეთი ეფექტები განსაკუთრებით ღირებულია იშემიურ გარემოში დაფიქსირებული ანთებითი რეაქციებისა და მიკროცირკულაციის დარღვევების შეხორცების ხელშეწყობისთვის, ასევე კომპარტმენტ სინდრომის მართვისთვის.
ჰიპერბოროტული თერაპიის (HBOT) გამოყენებამ ასევე შეიძლება გავლენა მოახდინოს იმუნურ სისტემაზე დამოკიდებულ მდგომარეობებზე. კვლევები მიუთითებს, რომ ჰიპერბოროტული თერაპიის (HBOT) გამოყენებამ შეიძლება დათრგუნოს აუტოიმუნური სინდრომები და ანტიგენით გამოწვეული იმუნური პასუხები, რაც ხელს უწყობს ტრანსპლანტატის ტოლერანტობის შენარჩუნებას ლიმფოციტებისა და ლეიკოციტების ცირკულაციის შემცირებით და იმუნური პასუხების მოდულირებით. გარდა ამისა, ჰიპერბოროტული თერაპიის (HBOT) გამოყენებამ შეიძლება გამოიწვიოს აუტოიმუნური სინდრომების და ანტიგენით გამოწვეული იმუნური პასუხების დათრგუნვა.ხელს უწყობს შეხორცებასქრონიკული კანის დაზიანებების დროს ანგიოგენეზის სტიმულირებით, რაც გაუმჯობესებული აღდგენის კრიტიკული პროცესია. ეს თერაპია ასევე ხელს უწყობს კოლაგენის მატრიქსის ფორმირებას, რაც ჭრილობების შეხორცების აუცილებელი ფაზაა.
განსაკუთრებული ყურადღება უნდა მიექცეს გარკვეულ ინფექციებს, განსაკუთრებით ღრმა და ძნელად სამკურნალო ინფექციებს, როგორიცაა ნეკროზული ფასციიტი, ოსტეომიელიტი, ქრონიკული რბილი ქსოვილების ინფექციები და ინფექციური ენდოკარდიტი. ჰიპერბოროტიდული თერაპიის (HBOT) ერთ-ერთი ყველაზე გავრცელებული კლინიკური გამოყენებაა კანისა და რბილი ქსოვილების ინფექციების და ოსტეომიელიტის დროს, რომელიც დაკავშირებულია ჟანგბადის დაბალ დონესთან და ხშირად გამოწვეულია ანაერობული ან რეზისტენტული ბაქტერიებით.
1. დიაბეტური ტერფის ინფექციები
დიაბეტური ტერფიწყლულები დიაბეტით დაავადებულ პაციენტებში გავრცელებული გართულებაა, რომელიც ამ პოპულაციის 25%-მდე აწუხებს. ამ წყლულებს ხშირად აღენიშნებათ ინფექციები (შემთხვევათა 40%-80%) და ზრდიან ავადობასა და სიკვდილიანობას. დიაბეტური ტერფის ინფექციები (DFIs) ჩვეულებრივ პოლიმიკრობული ინფექციებისგან შედგება, რომელთა დროსაც იდენტიფიცირებულია სხვადასხვა ანაერობული ბაქტერიული პათოგენები. დიაბეტით დაავადებულ პაციენტებში ჭრილობების შეხორცებას ხელს უშლის სხვადასხვა ფაქტორი, მათ შორის ფიბრობლასტების ფუნქციის დეფექტები, კოლაგენის წარმოქმნის პრობლემები, უჯრედული იმუნური მექანიზმები და ფაგოციტების ფუნქცია. რამდენიმე კვლევამ კანის ჟანგბადით მომარაგების დარღვევა DFIs-თან დაკავშირებული ამპუტაციების ძლიერ რისკ-ფაქტორად გამოავლინა.
როგორც DFI მკურნალობის ერთ-ერთი მიმდინარე ვარიანტი, ცნობილია, რომ ჰიპერტროფიული თერაპიის (HBOT) თერაპია მნიშვნელოვნად აუმჯობესებს დიაბეტური ტერფის წყლულების შეხორცების მაჩვენებელს, რაც შემდგომში ამცირებს ამპუტაციებისა და რთული ქირურგიული ჩარევების საჭიროებას. ის არა მხოლოდ მინიმუმამდე ამცირებს რესურსების მომთხოვნი პროცედურების, როგორიცაა ფლაპის ოპერაციები და კანის გადანერგვა, საჭიროებას, არამედ ქირურგიულ ვარიანტებთან შედარებით უფრო დაბალ ფასს და მინიმალურ გვერდით მოვლენებს ავლენს. ჩენის და სხვების მიერ ჩატარებულმა კვლევამ აჩვენა, რომ ჰიპერტროფიული თერაპიის 10-ზე მეტმა სესიამ დიაბეტით დაავადებულ პაციენტებში ჭრილობების შეხორცების მაჩვენებელი 78.3%-ით გააუმჯობესა.
2. ნეკროზული რბილი ქსოვილების ინფექციები
ნეკროზული რბილი ქსოვილების ინფექციები (NSTI) ხშირად პოლიმიკრობულია, როგორც წესი, წარმოიქმნება აერობული და ანაერობული ბაქტერიული პათოგენების კომბინაციით და ხშირად ასოცირდება აირების წარმოქმნასთან. მიუხედავად იმისა, რომ NSTI შედარებით იშვიათია, მათ ახასიათებთ მაღალი სიკვდილიანობის მაჩვენებელი მათი სწრაფი პროგრესირების გამო. დროული და შესაბამისი დიაგნოზი და მკურნალობა მნიშვნელოვანია ხელსაყრელი შედეგების მისაღწევად და ჰიპერტონიული თერაპია რეკომენდებულია, როგორც დამატებითი მეთოდი NSTI-ების მართვისთვის. მიუხედავად იმისა, რომ პერსპექტიული კონტროლირებადი კვლევების არარსებობის გამო, HBOT-ის გამოყენებასთან დაკავშირებით კვლავ არსებობს კამათი NSTI-ების დროს,მტკიცებულებები მიუთითებს, რომ ეს შეიძლება კორელაციაში იყოს NSTI პაციენტებში გადარჩენის მაჩვენებლების გაუმჯობესებასთან და ორგანოების შენარჩუნებასთან.რეტროსპექტულმა კვლევამ აჩვენა სიკვდილიანობის მნიშვნელოვანი შემცირება HBOT-ის მიმღებ არასტეროიდული ინფექციის მქონე პაციენტებში.
1.3 ქირურგიული ჩარევის ადგილის ინფექციები
ინფექციის ანატომიური ადგილმდებარეობის მიხედვით, სგს-ების კლასიფიკაცია შესაძლებელია და შეიძლება წარმოიშვას სხვადასხვა პათოგენისგან, მათ შორის როგორც აერობული, ასევე ანაერობული ბაქტერიებისგან. ინფექციის კონტროლის ზომების, როგორიცაა სტერილიზაციის ტექნიკა, პროფილაქტიკური ანტიბიოტიკების გამოყენება და ქირურგიული პრაქტიკის გაუმჯობესება, სგს კვლავ მუდმივ გართულებად რჩება.
ერთ-ერთმა მნიშვნელოვანმა მიმოხილვამ შეისწავლა ჰიპერტროფიული თერაპიის ეფექტურობა ღრმა ქირურგიული ინფექციების პრევენციაში ნერვ-კუნთოვანი სქოლიოზის ოპერაციის დროს. ოპერაციამდელი ჰიპერტროფიული თერაპიის ეფექტურობამ შესაძლოა მნიშვნელოვნად შეამციროს ქირურგიული ინფექციების შემთხვევები და ხელი შეუწყოს ჭრილობების შეხორცებას. ეს არაინვაზიური თერაპია ქმნის გარემოს, სადაც ჭრილობის ქსოვილებში ჟანგბადის დონე მომატებულია, რაც დაკავშირებულია პათოგენების წინააღმდეგ ჟანგვითი მკვლელობის მოქმედებასთან. გარდა ამისა, ის ებრძვის სისხლში და ჟანგბადის დაბალ დონეს, რაც ხელს უწყობს ქირურგიული ინფექციების განვითარებას. სხვა ინფექციის კონტროლის სტრატეგიებთან ერთად, ჰიპერტროფიული თერაპიის გამოყენება განსაკუთრებით რეკომენდებულია სუფთა დაბინძურებული ოპერაციებისთვის, როგორიცაა კოლორექტალური პროცედურები.
1.4 დამწვრობა
დამწვრობა არის დაზიანებები, რომლებიც გამოწვეულია უკიდურესი სიცხით, ელექტროდენით, ქიმიკატებით ან რადიაციით და შეიძლება გამოიწვიოს მაღალი ავადობისა და სიკვდილიანობის მაჩვენებლები. HBOT სასარგებლოა დამწვრობის სამკურნალოდ დაზიანებულ ქსოვილებში ჟანგბადის დონის გაზრდით. მიუხედავად იმისა, რომ ცხოველებზე და კლინიკურ კვლევებში შერეული შედეგებია მოცემული.HBOT-ის ეფექტურობა დამწვრობის მკურნალობაში125 დამწვრობის მქონე პაციენტის მონაწილეობით ჩატარებულმა კვლევამ აჩვენა, რომ ჰიპერმგრძნობელობის თერაპიის (HBOT) გავლენა არ მოახდინა სიკვდილიანობის მაჩვენებელზე ან ჩატარებული ოპერაციების რაოდენობაზე, თუმცა შეამცირა საშუალო შეხორცების დრო (19.7 დღე 43.8 დღემდე). HBOT-ის ინტეგრირება დამწვრობის ყოვლისმომცველ მართვასთან შეიძლება ეფექტურად აკონტროლოს სეფსისი დამწვრობის მქონე პაციენტებში, რაც გამოიწვევს შეხორცების დროის შემცირებას და სითხის მოთხოვნილების შემცირებას. თუმცა, საჭიროა შემდგომი ფართომასშტაბიანი პერსპექტიული კვლევები, რათა დადასტურდეს HBOT-ის როლი ფართო დამწვრობის მართვაში.
1.5 ოსტეომიელიტი
ოსტეომიელიტი ძვლის ან ძვლის ტვინის ინფექციაა, რომელიც ხშირად გამოწვეულია ბაქტერიული პათოგენებით. ოსტეომიელიტის მკურნალობა შეიძლება რთული იყოს ძვლების შედარებით ცუდი სისხლის მიწოდებისა და ანტიბიოტიკების ძვლის ტვინში შეზღუდული შეღწევადობის გამო. ქრონიკული ოსტეომიელიტი ხასიათდება მუდმივი პათოგენებით, მსუბუქი ანთებით და ნეკროზული ძვლოვანი ქსოვილის წარმოქმნით. რეფრაქტერული ოსტეომიელიტი გულისხმობს ქრონიკულ ძვლის ინფექციებს, რომლებიც გრძელდება ან მეორდება შესაბამისი მკურნალობის მიუხედავად.
ჰიპერბოლური თერაპიის (HBOT) გამოყენება მნიშვნელოვნად აუმჯობესებს ჟანგბადის დონეს ინფიცირებულ ძვლოვან ქსოვილებში. მრავალრიცხოვანი შემთხვევების სერია და კოჰორტული კვლევები მიუთითებს, რომ ჰიპერბოლური თერაპიის (HBOT) გამოყენება აუმჯობესებს ოსტეომიელიტის მქონე პაციენტებში კლინიკურ შედეგებს. როგორც ჩანს, ის მოქმედებს სხვადასხვა მექანიზმის მეშვეობით, მათ შორის მეტაბოლური აქტივობის გაძლიერებით, ბაქტერიული პათოგენების დათრგუნვით, ანტიბიოტიკების ეფექტის გაძლიერებით, ანთების მინიმიზაციით და შეხორცების ხელშეწყობით.პროცესები. HBOT-ის შემდეგ, ქრონიკული, რეფრაქტერული ოსტეომიელიტის მქონე პაციენტების 60%-დან 85%-მდე ინფექციის სუპრესიის ნიშნებს აღენიშნებათ.
1.6 სოკოვანი ინფექციები
გლობალურად, სამ მილიონზე მეტი ადამიანი იტანჯება ქრონიკული ან ინვაზიური სოკოვანი ინფექციებით, რაც ყოველწლიურად 600 000-ზე მეტ სიკვდილს იწვევს. სოკოვანი ინფექციების მკურნალობის შედეგები ხშირად ზიანდება ისეთი ფაქტორების გამო, როგორიცაა იმუნური სტატუსის ცვლილება, ძირითადი დაავადებები და პათოგენის ვირულენტობის მახასიათებლები. ჰიპერმგრძნობელობის თერაპია (HBOT) მისი უსაფრთხოებისა და არაინვაზიური ბუნების გამო, მძიმე სოკოვანი ინფექციების დროს მიმზიდველ თერაპიულ ვარიანტად იქცევა. კვლევები მიუთითებს, რომ ჰიპერმგრძნობელობის თერაპია (HBOT) შეიძლება ეფექტური იყოს სოკოვანი პათოგენების, როგორიცაა Aspergillus და Mycobacterium tuberculosis, წინააღმდეგ.
HBOT ხელს უწყობს სოკოს საწინააღმდეგო ეფექტებს Aspergillus-ის ბიოაპკის წარმოქმნის ინჰიბირებით, რაც გაზრდილი ეფექტურობით ხასიათდება სუპეროქსიდდისმუტაზას (SOD) გენების არმქონე შტამებში. სოკოვანი ინფექციების დროს ჰიპოქსიური პირობები სოკოს საწინააღმდეგო პრეპარატების მიწოდებას სირთულეებს უქმნის, რაც HBOT-ით გამოწვეულ ჟანგბადის დონის მომატებას პოტენციურად სასარგებლო ჩარევად აქცევს, თუმცა შემდგომი კვლევების ჩატარება აუცილებელია.
HBOT-ის ანტიმიკრობული თვისებები
ჰიპეროქსიური თერაპიის (HBOT) მიერ შექმნილი ჰიპეროქსიური გარემო იწყებს ფიზიოლოგიურ და ბიოქიმიურ ცვლილებებს, რომლებიც ასტიმულირებს ანტიბაქტერიულ თვისებებს, რაც მას ინფექციის სამკურნალოდ ეფექტურ დამატებით თერაპიად აქცევს. HBOT ავლენს შესანიშნავ ეფექტს აერობული ბაქტერიების და უპირატესად ანაერობული ბაქტერიების წინააღმდეგ ისეთი მექანიზმების მეშვეობით, როგორიცაა პირდაპირი ბაქტერიციდული აქტივობა, იმუნური პასუხების გაძლიერება და სინერგიული ეფექტები სპეციფიკურ ანტიმიკრობულ აგენტებთან.
2.1 HBOT-ის პირდაპირი ანტიბაქტერიული ეფექტები
HBOT-ის პირდაპირი ანტიბაქტერიული ეფექტი დიდწილად განპირობებულია რეაქტიული ჟანგბადის სახეობების (ROS) გენერაციით, რომლებიც მოიცავს სუპეროქსიდის ანიონებს, წყალბადის ზეჟანგს, ჰიდროქსილის რადიკალებს და ჰიდროქსილის იონებს - რომლებიც ყველა მათგანი წარმოიქმნება უჯრედული მეტაბოლიზმის დროს.
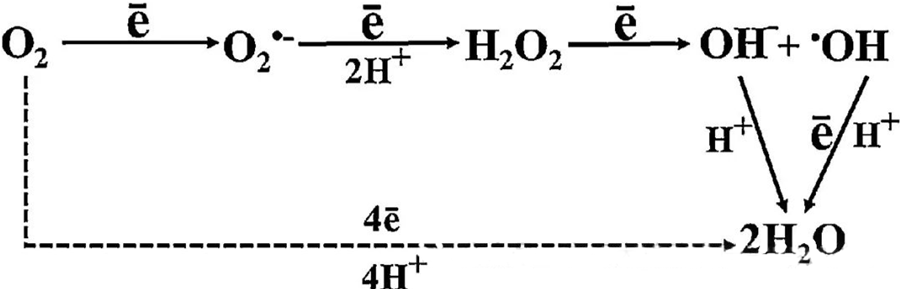
უჯრედებში ROS-ის წარმოქმნის გასაგებად აუცილებელია O₂-სა და უჯრედულ კომპონენტებს შორის ურთიერთქმედება. გარკვეულ პირობებში, რომლებსაც ჟანგვითი სტრესი ეწოდება, ROS-ის წარმოქმნასა და მის დაშლას შორის ბალანსი ირღვევა, რაც უჯრედებში ROS-ის დონის მატებას იწვევს. სუპეროქსიდის (O₂⁻) წარმოქმნას კატალიზებს სუპეროქსიდდისმუტაზა, რომელიც შემდგომში O₂⁻-ს წყალბადის ზეჟანგად (H₂O₂) გარდაქმნის. ეს გარდაქმნა კიდევ უფრო ძლიერდება ფენტონის რეაქციით, რომელიც ჟანგავს Fe²⁺-ს ჰიდროქსილის რადიკალების (·OH) და Fe₳⁺-ის წარმოქმნით, რითაც იწყება ROS-ის წარმოქმნისა და უჯრედული დაზიანების მავნე რედოქს თანმიმდევრობა.
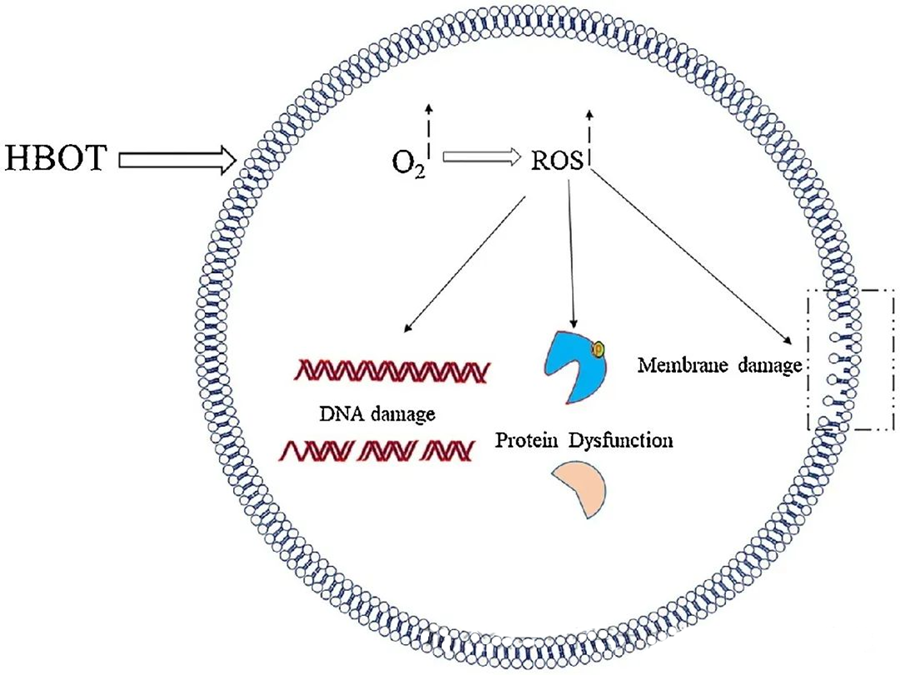
ROS-ის ტოქსიკური ეფექტები მიმართულია უჯრედის ისეთ კრიტიკულ კომპონენტებზე, როგორიცაა დნმ, რნმ, ცილები და ლიპიდები. აღსანიშნავია, რომ დნმ H₂O₂-ით განპირობებული ციტოტოქსიკურობის ძირითადი სამიზნეა, რადგან ის არღვევს დეოქსირიბოზის სტრუქტურებს და აზიანებს ფუძეების შემადგენლობებს. ROS-ით გამოწვეული ფიზიკური დაზიანება ვრცელდება დნმ-ის სპირალურ სტრუქტურაზე, რაც პოტენციურად გამოწვეულია ROS-ით გამოწვეული ლიპიდური პეროქსიდაციით. ეს ხაზს უსვამს ROS-ის მომატებული დონის უარყოფით შედეგებს ბიოლოგიურ სისტემებში.
ROS-ის ანტიმიკრობული მოქმედება
ROS მნიშვნელოვან როლს ასრულებს მიკრობული ზრდის ინჰიბირებაში, რასაც ადასტურებს HBOT-ით ინდუცირებული ROS-ის გენერაცია. ROS-ის ტოქსიკური ეფექტები პირდაპირ მიმართულია უჯრედის შემადგენელ ნაწილებზე, როგორიცაა დნმ, ცილები და ლიპიდები. აქტიური ჟანგბადის სახეობების მაღალმა კონცენტრაციამ შეიძლება პირდაპირ დააზიანოს ლიპიდები, რაც იწვევს ლიპიდების პეროქსიდაციას. ეს პროცესი საფრთხეს უქმნის უჯრედის მემბრანების მთლიანობას და, შესაბამისად, მემბრანასთან ასოცირებული რეცეპტორებისა და ცილების ფუნქციონირებას.
გარდა ამისა, ცილები, რომლებიც ასევე წარმოადგენენ ROS-ის მნიშვნელოვან მოლეკულურ სამიზნეებს, განიცდიან სპეციფიკურ ჟანგვით მოდიფიკაციებს სხვადასხვა ამინომჟავის ნარჩენებზე, როგორიცაა ცისტეინი, მეთიონინი, ტიროზინი, ფენილალანინი და ტრიპტოფანი. მაგალითად, ნაჩვენებია, რომ HBOT იწვევს ჟანგვით ცვლილებებს E. coli-ს რამდენიმე ცილაში, მათ შორის დაგრძელების ფაქტორ G-სა და DnaK-ში, რითაც გავლენას ახდენს მათ უჯრედულ ფუნქციებზე.
იმუნიტეტის გაძლიერება HBOT-ის მეშვეობით
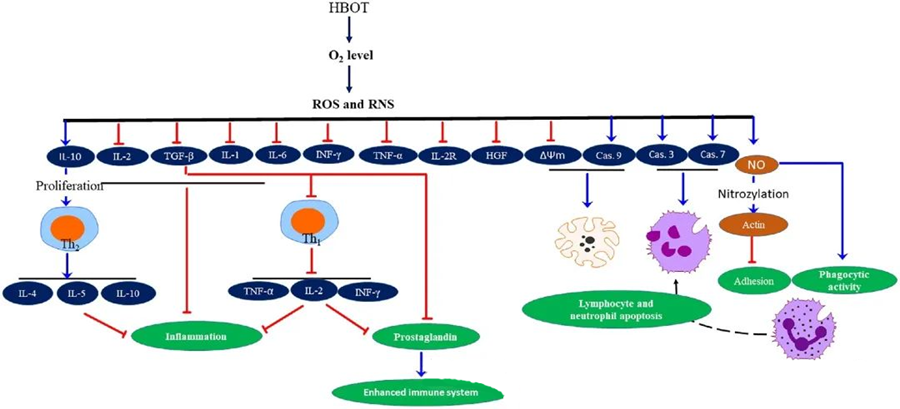
HBOT-ის ანთების საწინააღმდეგო თვისებებიდოკუმენტირებულია, რაც გადამწყვეტ როლს თამაშობს ქსოვილების დაზიანების შემსუბუქებასა და ინფექციის პროგრესირების დათრგუნვაში. ჰიპერბურთეზიურმა თერაპიამ (HBOT) მნიშვნელოვნად იმოქმედა ციტოკინებისა და სხვა ანთებითი რეგულატორების ექსპრესიაზე, რაც გავლენას ახდენს იმუნურ პასუხზე. სხვადასხვა ექსპერიმენტულმა სისტემამ დააკვირდა გენების ექსპრესიისა და ცილების გენერაციის დიფერენციალურ ცვლილებებს HBOT-ის შემდეგ, რაც ან ზრდის, ან ამცირებს ზრდის ფაქტორებსა და ციტოკინებს.
ჰიპერბოროტიდური თერაპიის (HBOT) პროცესის დროს, O₂ დონის მომატება იწვევს უჯრედული რეაქციების ფართო სპექტრს, როგორიცაა პროანთებითი მედიატორების გამოთავისუფლების დათრგუნვა და ლიმფოციტებისა და ნეიტროფილების აპოპტოზის ხელშეწყობა. ერთობლივად, ეს მოქმედებები აძლიერებს იმუნური სისტემის ანტიმიკრობულ მექანიზმებს, რითაც ხელს უწყობს ინფექციებისგან განკურნებას.
გარდა ამისა, კვლევები მიუთითებს, რომ ჰიპერტროფიული თერაპიის (HBOT) დროს O₂ დონის მომატებამ შეიძლება შეამციროს პროანთებითი ციტოკინების, მათ შორის ინტერფერონ-გამას (IFN-γ), ინტერლეიკინ-1-ის (IL-1) და ინტერლეიკინ-6-ის (IL-6) ექსპრესიის დონე. ეს ცვლილებები ასევე მოიცავს CD4:CD8 T უჯრედების თანაფარდობის შემცირებას და სხვა ხსნადი რეცეპტორების მოდულირებას, რაც საბოლოოდ ზრდის ინტერლეიკინ-10-ის (IL-10) დონეს, რაც გადამწყვეტია ანთების საწინააღმდეგოდ და შეხორცების ხელშეწყობისთვის.
ჰიპეროქსიდის ანტიმიკრობული აქტივობა გადაჯაჭვულია რთულ ბიოლოგიურ მექანიზმებთან. როგორც სუპეროქსიდი, ასევე მომატებული წნევა, არათანმიმდევრულად უწყობს ხელს ჰიპეროქსიდის ანტიბაქტერიულ აქტივობას და ნეიტროფილების აპოპტოზს. ჰიპეროქსიდის თერაპიის შემდეგ, ჟანგბადის დონის მნიშვნელოვანი მატება აძლიერებს ნეიტროფილების ბაქტერიციდულ შესაძლებლობებს, რაც იმუნური პასუხის აუცილებელი კომპონენტია. გარდა ამისა, ჰიპეროქსიდის თერაპია თრგუნავს ნეიტროფილების ადჰეზიას, რაც განპირობებულია ნეიტროფილებზე β-ინტეგრინების ურთიერთქმედებით ენდოთელურ უჯრედებზე უჯრედშორისი ადჰეზიის მოლეკულებთან (ICAM). ჰიპეროქსიდის თერაპია აზოტის ოქსიდით (NO) განპირობებული პროცესის მეშვეობით აფერხებს ნეიტროფილების β-2 ინტეგრინის (Mac-1, CD11b/CD18) აქტივობას, რაც ხელს უწყობს ნეიტროფილების მიგრაციას ინფექციის კერაში.
ციტოჩონჩხის ზუსტი გადალაგება აუცილებელია ნეიტროფილებისთვის პათოგენების ეფექტური ფაგოციტიზაციისთვის. აქტინის S-ნიტროსილირება ასტიმულირებს აქტინის პოლიმერიზაციას, რაც პოტენციურად ხელს უწყობს ნეიტროფილების ფაგოციტურ აქტივობას ჰიპერტროფიული თერაპიის (HBOT) წინასწარი დამუშავების შემდეგ. გარდა ამისა, HBOT ხელს უწყობს ადამიანის T უჯრედების აპოპტოზს მიტოქონდრიული გზებით, ხოლო HBOT-ის შემდეგ ლიმფოციტების დაჩქარებული სიკვდილი დაფიქსირდა. კასპაზა-9-ის ბლოკირებამ - კასპაზა-8-ზე ზემოქმედების გარეშე - აჩვენა HBOT-ის იმუნომოდულატორული ეფექტები.
HBOT-ის სინერგიული ეფექტები ანტიმიკრობულ აგენტებთან
კლინიკურ პრაქტიკაში, ჰიპეროქსიური თერაპიის (HBOT) დროს ხშირად გამოიყენება ანტიბიოტიკებთან ერთად ინფექციებთან ეფექტური ბრძოლის მიზნით. ჰიპეროქსიური თერაპიის (HBOT) დროს მიღწეულმა ჰიპეროქსიურმა მდგომარეობამ შეიძლება გავლენა მოახდინოს გარკვეული ანტიბიოტიკური საშუალებების ეფექტურობაზე. კვლევები აჩვენებს, რომ სპეციფიკური ბაქტერიციდული პრეპარატები, როგორიცაა β-ლაქტამები, ფტორქინოლონები და ამინოგლიკოზიდები, არა მხოლოდ მოქმედებენ თანდაყოლილი მექანიზმებით, არამედ ნაწილობრივ ეყრდნობიან ბაქტერიების აერობულ მეტაბოლიზმს. ამიტომ, ანტიბიოტიკების თერაპიული ეფექტების შეფასებისას გადამწყვეტი მნიშვნელობა აქვს ჟანგბადის არსებობას და პათოგენების მეტაბოლურ მახასიათებლებს.
მნიშვნელოვანი მტკიცებულებები აჩვენებს, რომ ჟანგბადის დაბალმა დონემ შეიძლება გაზარდოს Pseudomonas aeruginosa-ს რეზისტენტობა პიპერაცილინის/ტაზობაქტამის მიმართ და რომ დაბალი ჟანგბადის გარემო ასევე ხელს უწყობს Enterobacter cloacae-ს რეზისტენტობის გაზრდას აზითრომიცინის მიმართ. პირიქით, ჰიპოქსიურმა გარკვეულმა მდგომარეობებმა შეიძლება გაზარდოს ბაქტერიების მგრძნობელობა ტეტრაციკლინის ანტიბიოტიკების მიმართ. HBOT ემსახურება როგორც სიცოცხლისუნარიან დამატებით თერაპიულ მეთოდს აერობული მეტაბოლიზმის ინდუცირებით და ჰიპოქსიური ინფიცირებული ქსოვილების რეოქსიგენაციით, რაც შემდგომში ზრდის პათოგენების მგრძნობელობას ანტიბიოტიკების მიმართ.
პრეკლინიკურ კვლევებში, HBOT-ის კომბინაციამ - რომელიც მიღებული იყო დღეში ორჯერ 8 საათის განმავლობაში 280 კპა წნევაზე - ტობრამიცინთან (20 მგ/კგ/დღეში) ერთად მნიშვნელოვნად შეამცირა ბაქტერიული დატვირთვა Staphylococcus aureus-ით გამოწვეული ინფექციური ენდოკარდიტის დროს. ეს აჩვენებს HBOT-ის პოტენციალს, როგორც დამხმარე მკურნალობის. შემდგომმა კვლევებმა აჩვენა, რომ 37°C ტემპერატურაზე და 3 ATA წნევაზე 5 საათის განმავლობაში, HBOT-მა მნიშვნელოვნად გააძლიერა იმიპენემის ეფექტი მაკროფაგებით ინფიცირებული Pseudomonas aeruginosa-ს წინააღმდეგ. გარდა ამისა, HBOT-ის და ცეფაზოლინის კომბინირებული მეთოდი უფრო ეფექტური აღმოჩნდა Staphylococcus aureus-ის ოსტეომიელიტის სამკურნალოდ ცხოველურ მოდელებში, მხოლოდ ცეფაზოლინთან შედარებით.
HBOT ასევე მნიშვნელოვნად ზრდის ციპროფლოქსაცინის ბაქტერიციდულ მოქმედებას Pseudomonas aeruginosa-ს ბიოფილმების წინააღმდეგ, განსაკუთრებით 90 წუთიანი ზემოქმედების შემდეგ. ეს გაძლიერება განპირობებულია ენდოგენური რეაქტიული ჟანგბადის სახეობების (ROS) წარმოქმნით და პეროქსიდაზა-დეფექტურ მუტანტებში ავლენს მომატებულ მგრძნობელობას.
მეთიცილინ-რეზისტენტული ოქროსფერი სტაფილოკოკის (MRSA) მიერ გამოწვეული პლევრიტის მოდელებში, ვანკომიცინის, ტეიკოპლანინის და ლინეზოლიდის თანამშრომლობითმა ეფექტმა HBOT-თან მნიშვნელოვნად გაზარდა ეფექტურობა MRSA-ს წინააღმდეგ. მეტრონიდაზოლი, ანტიბიოტიკი, რომელიც ფართოდ გამოიყენება მძიმე ანაერობული და პოლიმიკრობული ინფექციების, როგორიცაა დიაბეტური ტერფის ინფექციები (DFIs) და ქირურგიული ჩარევის ადგილის ინფექციები (SSIs), სამკურნალოდ, უფრო მაღალი ანტიმიკრობული ეფექტურობა აჩვენა ანაერობულ პირობებში. სამომავლო კვლევები საჭიროებს HBOT-ის სინერგიული ანტიბაქტერიული ეფექტების შესწავლას მეტრონიდაზოლთან ერთად, როგორც in vivo, ასევე in vitro პირობებში.
HBOT-ის ანტიმიკრობული ეფექტურობა რეზისტენტულ ბაქტერიებზე
რეზისტენტული შტამების ევოლუციასა და გავრცელებასთან ერთად, ტრადიციული ანტიბიოტიკები ხშირად კარგავენ თავიანთ ეფექტურობას დროთა განმავლობაში. გარდა ამისა, ჰიპერმგრძნობელობის თერაპიის (HBOT) გამოყენება შეიძლება აუცილებელი აღმოჩნდეს მრავალწამლის მიმართ რეზისტენტული პათოგენებით გამოწვეული ინფექციების მკურნალობისა და პრევენციისთვის, რაც კრიტიკულ სტრატეგიას წარმოადგენს ანტიბიოტიკებით მკურნალობის უშედეგობის შემთხვევაში. მრავალრიცხოვანმა კვლევებმა აჩვენა ჰიპერმგრძნობელობის თერაპიის (HBOT) მნიშვნელოვანი ბაქტერიციდული ეფექტები კლინიკურად მნიშვნელოვან რეზისტენტულ ბაქტერიებზე. მაგალითად, 90-წუთიანი HBOT სესიამ 2 ATM-ზე მნიშვნელოვნად შეამცირა MRSA-ს ზრდა. გარდა ამისა, თანაფარდობის მოდელებში, HBOT-მა გააძლიერა სხვადასხვა ანტიბიოტიკების ანტიბაქტერიული ეფექტები MRSA ინფექციების წინააღმდეგ. ანგარიშებმა დაადასტურა, რომ HBOT ეფექტურია OXA-48-ის წარმომქმნელი Klebsiella pneumoniae-თი გამოწვეული ოსტეომიელიტის სამკურნალოდ, დამატებითი ანტიბიოტიკების გამოყენების გარეშე.
შეჯამებისთვის, ჰიპერბარული ჟანგბადის თერაპია წარმოადგენს ინფექციის კონტროლის მრავალმხრივ მიდგომას, რომელიც აძლიერებს იმუნურ პასუხს და ამავდროულად აძლიერებს არსებული ანტიმიკრობული საშუალებების ეფექტურობას. ყოვლისმომცველი კვლევისა და განვითარების შედეგად, მას აქვს ანტიბიოტიკების მიმართ რეზისტენტობის ეფექტების შემსუბუქების პოტენციალი, რაც იმედს იძლევა ბაქტერიული ინფექციების წინააღმდეგ მიმდინარე ბრძოლაში.
გამოქვეყნების დრო: 2025 წლის 28 თებერვალი

